Ⅰ、目的
為規(guī)范我院的人類遺傳資源管理,特制定本制度。
Ⅱ、范圍
1.凡外資(包括獨資、合資)企業(yè)申報的國際合作項目,涉及采集、 收集、出口、出境等各種人類遺傳資源。
2.中國內(nèi)資企業(yè)的臨床試驗符合下列條件之一:
2.1采集環(huán)節(jié)涉及特定地區(qū)和重要遺傳家系。
2.2以保藏為目的的收集活動。
2.3實體樣本需要出口、出境。
2.4遺傳材料實體樣本和(或)有關(guān)數(shù)據(jù)收集交由外資CRO承擔(dān)的。
3.人類遺傳資源指含有人體基因組、基因及其產(chǎn)物的器官、組織、 細(xì)胞、核酸、核酸制品等資源材料及其產(chǎn)生的信息資料。
Ⅲ、依據(jù)
《藥物臨床試驗質(zhì)量管理規(guī)范》(2020年版)
《中華人民共和國人類遺傳資源管理條例》(2019年)
Ⅳ、規(guī)程
1.管理規(guī)范
1.1 本院不是作為多中心臨床試驗的組長單位,原則上由申辦方委托組長單位主要研究者牽頭所有研究中心向國家人類遺傳資源管理辦公室 提出申請,或委托中心實驗室所在地研究中心主要研究者向國家人類遺傳資源管理辦公室提出申請。
1.2 若申辦方與本院為同一省屬轄區(qū)且本院為牽頭單位,本院可牽頭省屬轄區(qū)的其他研究中心向國家人類遺傳資源管理辦公室提出申請。
1.3 本院作為單獨研究中心向國家人類遺傳資源管理辦公室提出申請。
2.注意事項:申請書要以醫(yī)院為申請對象,涉及醫(yī)院內(nèi)容必須與官網(wǎng)和科室實際情況相吻合,涉及標(biāo)本類型和數(shù)量要以個體受試者為單位描述清楚,各合作方涉及標(biāo)本工作內(nèi)容和樣本的去向均要描述清楚。人遺獲得科技部審批通過后,領(lǐng)取委托函提交機(jī)構(gòu)蓋章,并及時把批件遞交機(jī)構(gòu)和倫理備案。
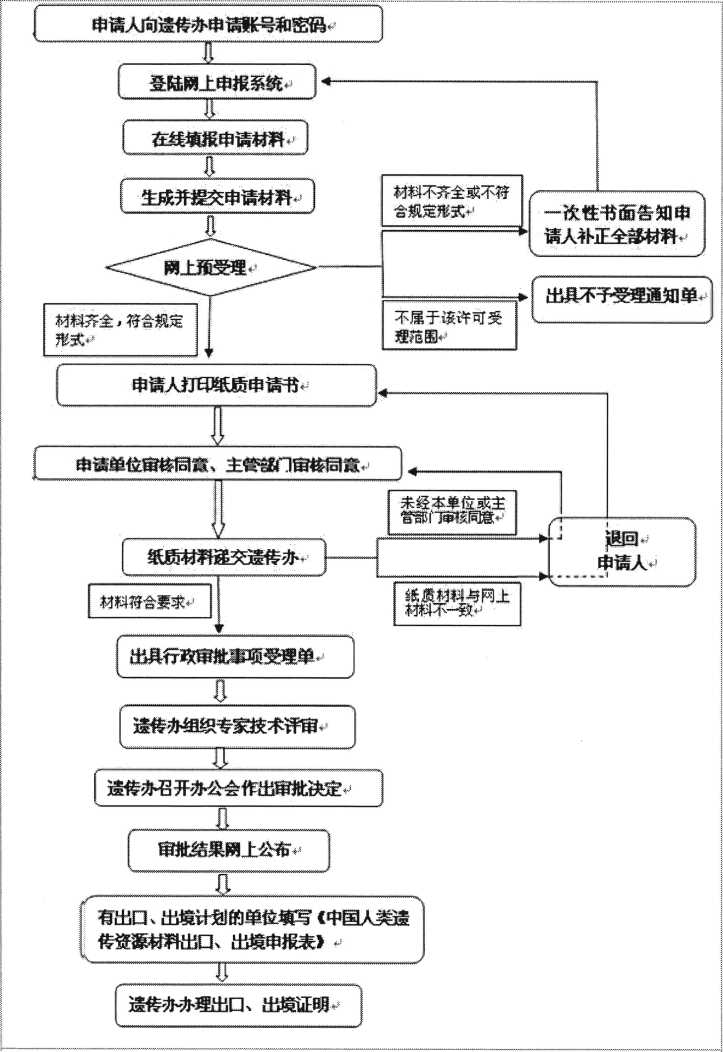
3.過程管理
3.1人類遺傳資源辦公室批準(zhǔn)(網(wǎng)上)后方可開展臨床試驗并進(jìn)行標(biāo)本采集。
在試驗中增加人類遺傳資源的申報項目需重新上會,經(jīng)倫理委員會批準(zhǔn)后再按上述程序申報,并簽補(bǔ)充協(xié)議。
3.2對生物樣本過程文件進(jìn)行存檔:申辦方應(yīng)根據(jù)試驗進(jìn)度定期遞交涉及生物樣本動向的各類記錄單,包括并不限于以下各類表單:生物樣本采集單、生物樣本離心單、運(yùn)輸單、溫控單、交接單、接收回執(zhí)單或簽收其他證明材料、物流公司的資質(zhì)證書、生物樣本銷毀記錄單等。
3.3對于多中心申報、按總量申報的項目,作為組長單位,項目組要定期匯總分中心的量,計算出總量,避免超量。管理部門要對照批件進(jìn)行審查。
